31.03.2009
Z analizy testów CKE przeprowadzonej przez nauczycieli Firmy „MARKA”, wynika, iż pewne zagadnienia w testach egzaminacyjnych w latach 2002-2012 pojawiały się w częściej niż inne. Wielce prawdopodobne, że i w tym roku można spodziewać się tego typu zadań.
- umiejętność rozpoznawania związków chemicznych (znajomość ich nazw oraz wzorów sumarycznych i strukturalnych)
Przykład:
Podstawowymi składnikami substancji zapachowych wielu roślin są estry. Można je przedstawić wzorem ogólnym: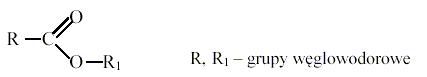
Estrem jest związek o wzorze:

Odpowiedź: D. - znajomość najważniejszych typów reakcji chemicznych
Przykład:
Elementy kolejki wąskotorowej wykonuje się ze stopu, w skład którego wchodzi żelazo. Pierwiastek ten w reakcji z pewnym kwasem tworzy chlorek żelaza (II). Równanie opisujące tę reakcję to:
A. Fe + Cl2 → FeCl2
B. 2 Fe + 3 Cl2 → 2 FeCl3
C. Fe + 2 HCl → FeCl2 + H2 ↑
D. 2 Fe + 6 HCl → 2 FeCl2 +3 H2 ↑Odpowiedź: C.
- znajomość pojęć dotyczących roztworów (nienasyconych i nasyconych) i rozpuszczalności
Przykład:
Wykres przedstawia zależność rozpuszczalności dwutlenku węgla w wodzie od temperatury: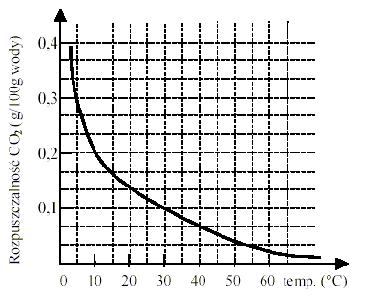
100 g wody o temperaturze 5°C nasycono dwutlenkiem węgla. Ile gramów CO2 wydzieli się w postaci gazu, gdy ten roztwór ogrzejemy do temperatury 30°C?
Odpowiedź: 0,2 g.
- umiejętność stosowania pojęcia stężenia procentowego roztworu
Przykład:
Woda morska zawiera średnio 3,5% soli. Ile wody destylowanej należy dolać do 100 g wody morskiej, aby otrzymać roztwór o stężeniu dwa razy mniejszym?A. 100g
B. 96,5 g
C. 98,25 g
D. 200gOdpowiedź: A.
- znajomość zastosowań związków chemicznych w żywieniu i w życiu codziennym
Przykład:
Nadmierny wzrost stężenia kwasu solnego w żołądku człowieka powoduje chorobę zwaną nadkwasotą. Która z substancji, będąc składnikiem lekarstwa na nadkwasotę, zmniejszałaby stężenie kwasu?A. Chlorek sodu – NaCl.
B. Roztwór kwasu octowego – CH3COOH.
C. Wodorotlenek glinu – Al(OH)3.
D. Roztwór glukozy – C6H12O6.Odpowiedź: C – zajdzie reakcja zobojętniania.
Umiejętność stosowania pojęcia stężenia procentowego roztworu, zastosowania wzoru na stężenie do obliczeń chemicznych.
Woda morska zawiera średnio 3,5% soli.
Zadanie 1. (0–1)
Ile soli zawierają 2 kilogramy wody morskiej?
A.7 g B. 70 g C. 700 g D. 7000 g
Odp.B
Zadanie 2. (0–1)
Z ilu kilogramów wody morskiej otrzymamy 7 kilogramów soli?
A.2 B. 20 C. 200 D. 2000
Odp.C
Zadania z wykorzystaniem umiejętności odczytywania danych z wykresu i ich interpretacja, znajomości zastosowań związków chemicznych w żywieniu i w życiu codziennym, umiejętności posługiwania się skalą kwasowości.
Schemat i tabela do zadań 3 i 4
Skala pH służy do określania odczynu badanej substancji.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| Odczyn kwaśny | Odczyn obojętny | Odczyn zasadowy | |||||||||||
| Roztwór | pH |
|---|---|
| woda sodowa | 5,5 |
| sok pomarańczowy | 3,5 |
| coca-cola | 3,0 |
| mleko | 6,5 |
| woda destylowana | 7,0 |
| amoniak | 11,5 |
| preparat do udrażniania rur | 14,0 |
Zadanie 3. (0–1)
Który z podanych napojów ma najbardziej kwasowy odczyn?
A.Mleko. B. Coca-cola. C. Woda sodowa. D. Sok pomarańczowy.
Odp.B
Zadanie 4. (0–1)
Wybierz zdanie prawdziwe.
A. Woda sodowa ma odczyn zasadowy.
B. Woda destylowana ma odczyn obojętny.
C. Roztwór amoniaku ma odczyn kwasowy.
D. Preparat do udrażniania rur ma właściwości silnego kwasu.
Odp.B
Umiejętność odczytywania danych z układu okresowego i określanie właściwości pierwiastków chemicznych.
Schemat do zadań 5 i 6.
Wzrost aktywności chemicznej można przedstawić w następujący sposób:
| K Na Ca Mg Al Zn Fe Sn Pb H Bi Cu Hg Ag Pt Au |
Metale aktywniejsze od wodoru, wypierające go z zimnej wody i kwasów (reagują z zimną wodą). |
|
Metale aktywniejsze od wodoru, wypierające go z gorącej wody i kwasów (reagują z gorącą wodą i kwasem).
|
|
|
Metale mniej aktywne od wodoru, nie wypierające go z wody i kwasów.
|
Zadanie5. (0-1)
Wybierz zdanie prawdziwe.
A. Sód (Na) reaguje z wodą.
B. W reakcji srebra (Ag) z ZnCl2 wydzieli się cynk (Zn).
C. Złoto (Au) jest bardziej aktywne chemicznie niż potas (K).
D. W reakcji złota (Au) z kwasem siarkowym(VI) wydzieli się wodór.
Odp.A
Zadanie6. (0-1)
Przeprowadzono doświadczenia przedstawione na poniższym rysunku. W której probówce jednym z produktów reakcji jest wodór?
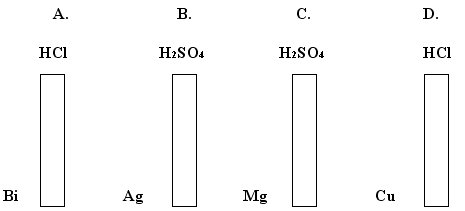
Odp.C
Umiejętność opisywania przedstawionych za pomocą rysunków doświadczeń chemicznych, formułowania spostrzeżeń i wniosków, zapisywania za pomocą równań reakcji chemicznych przedstawionych procesów.
Zadanie 7 (0 – 3)
Tomek wykonał doświadczenie, w którym na cynk podziałał kwasem solnym. Probówkę do zbierania wydzielającego się gazu umieścił w wanience z wodą. Rysunek przedstawia schemat tego doświadczenia.

1. Zapisz równanie reakcji zachodzącej w doświadczeniu.
Odp: Zn + 2HCl—>ZnCl2 + H2
2. Nazwij powstałe produkty reakcji, uzupełniając zdanie:
Odp: Produktami reakcji zachodzącej w doświadczeniu są: chlorek cynku (II) i wodór.
3. Napisz, w jaki sposób zidentyfikujesz wydzielający się gaz.
Odp: Do wylotu probówki z wydzielonym gaz przyłożę zapaloną zapałkę( łuczywo). Usłyszymy wtedy charakterystyczne pyknięcie( odgłos, szczęknięcie itp. określenia)
Umiejętność wskazania zastosowań związków chemicznych i reakcji chemicznych w procesach życiowych i w życiu codziennym ( umiejętność powiązania wiedzy chemicznej z biologiczną i fizyczną).
Zadanie8. (0-1)
Następnego dnia po wycieczce rowerowej uczestnicy odczuwali ból mięśni. Przyczyną tych dolegliwości był nagromadzony w mięśniach kwas mlekowy, powstający w wyniku
A. oddychania tlenowego.
B. oddychania beztlenowego.
C. wymiany gazowej w tkankach.
D. połączenia tlenu z hemoglobiną.
Odp.B
Zadanie 9. (0-1)
Procesy zachodzące w naszym otoczeniu przebiegają z wydzielaniem ciepła do otoczenia (egzotermiczne) lub z pobieraniem ciepła z otoczenia (endotermiczne). Procesem endotermicznym jest
A. prażenie skały wapiennej.
B. spalanie drewna w ognisku.
C. mieszanie wapna palonego z wodą.
D. wlewanie kwasu siarkowego do wody.
Odp.A
Zadanie 10. (0-1)
Podczas gotowania lub smażenia jaja kurzego, białko ścina się nieodwracalnie. Innym czynnikiem powodującym nieodwracalne ścinanie białka jest
A.zimna woda.
B. sól kuchenna.
C. alkohol etylowy.
D. roztwór cukru.
Odp.C
Umiejętność rozpoznawania związków organicznych, znajomość ich wzorów sumarycznych i umiejętność rozpoznawania grup funkcyjnych i klasyfikowania na ich podstawie do odpowiednich grup związków.
Zadanie 11. (0-1)
Marta przygotowała prowiant na wycieczkę rowerową. Pakowane przez nią produkty żywnościowe zawierają ważne dla organizmu związki chemiczne. Które z nich są dlaorganizmu głównie źródłem energii?
A. białka B. cukry C. sole mineralne D. Witaminy
Odp.B
Zadanie 12. (0-1)
Po całodniowej wycieczce rowerowej Marta odczuła ból w mięśniach spowodowany między innymi wytworzeniem się kwasu mlekowego. Związek ten można opisać
wzorem: CH3 CH COOH
OH
Zamieszczona w ramce grupa funkcyjna, charakterystyczna dla kwasów organicznych,nazywa się:
A. węglowodorową B. wodorotlenową C. karboksylową D. estrową
Odp.C
Umiejętność rozpoznawania związków chemicznych, znajomość ich wzorów sumarycznych i umiejętność klasyfikowania ich do odpowiednich grup związków(np. Sole, kwasy, zasady).
Zadanie 13. (0 – 1)
Wskaż zestaw, który zawiera wyłącznie wzory sumaryczne soli.
A.NaCl , MgSO4 , CaCl2 , HNO3
B. NaCl , CaSO4 , CaCl2 , Al(OH)3
C. NaCl, Ca(OH)2 , HCl , Mg3(PO4)2
D. NaCl , KNO3, MgSO4 , CaSO4
Znajomość rozpoznawania najważniejszych typów reakcji chemicznych, umiejętność pisania równań reakcji.
Zadanie 14. (0 – 1)
Wskaż reakcję zobojętniania.
A. 2Na + H2SO4 -> Na2SO4 + H2
B. 2NaOH + H2SO4 -> Na2SO4 + 2H2O
C. Na2O + H2SO4 -> Na 2SO4 + H2O
D. Na2CO3 + H2SO4 -> Na2SO4 + H2CO3
Odp.B
Zadanie 15. (0–2)
Woda gazowana zawiera rozpuszczony w wodzie dwutlenek węgla. Niewielkie ilości tego gazu reagują z wodą, tworząc kwas węglowy.
Napisz równanie reakcji tworzenia się tego kwasu.
Zadanie 16. (0-3)
Na zajęciach kółka chemicznego uczniowie przeprowadzali reakcję zobojętniania. Do roztworu wodorotlenku sodu (MNaOH = 40u) dodali fenoloftaleinę, a następnie wkraplali rozcieńczony roztwór kwasu mrówkowego (MHCOOH = 46u). Punkt zobojętnienia uzyskali w momencie odbarwienia wskaźnika. Zapisz równanie przeprowadzonej reakcji i oblicz, ile gramów kwasu potrzeba do zobojętnienia roztworu zawierającego 10 gramów NaOH.
Równanie.
Obliczenia: 40u 46u
M. NaOH =40u 10g x
M HCOOH=46u 40u/46u =10g/x
x=10g*46u/40u
x =11,5g
Odpowiedź: Do zobojętnienia zasady potrzeba 11,5g kwasu mrówkowego.
Umiejętność czytania ze zrozumieniem, wykonywania obliczeń chemicznych dotyczących obliczania mas cząsteczkowych.
Zadanie 17. (0 – 1)
Na rysunku przedstawiono wybrane informacje z układu okresowego pierwiastków.
(Masy atomowe podane są w zaokrągleniu do jedności).
|
24 Mg 12 magnez
|
75 As 33 arsen |
16 O 8 tlen |
Korzystając z nich, oblicz masę cząsteczkową związku chemicznego o wzorze
sumarycznym Mg3(AsO4)2.
A. 164 u
B. 211 u
C. 350 u
D.130 u
Odp.D
Zadanie 18. (0-2)
Pewien pierwiastek, umownie oznaczony literą E, tworzy tlenek o ogólnym wzorze EO3.
Jaki to pierwiastek, jeżeli masa cząsteczkowa jego tlenku wynosi 80u? Zapisz obliczenia.( Masa atomowa tlenu=16u)
Obliczenia:
mE = mczą – 3mO
mE = 80u – 3* 16u
mE = 32u E = S (siarka)
Odp. Szukanym pierwiastkiem jest siarka ( m=32u).
Umiejętność stosowania pojęcia stężenia procentowego roztworu, zastosowania wzoru na stężenie do obliczeń chemicznych.
Woda morska zawiera średnio 3,5% soli.
Zadanie 19. (0-1)
Ile soli zawierają 2 kilogramy wody morskiej?
A. 7 g B. 70 g C. 700 g D. 7000 g
Odp.C
Zadanie 20. (0-1)
Z ilu kilogramów wody morskiej otrzymamy 7 kilogramów soli?
A.2 B. 20 C. 200 D. 2000
Odp.C
Sprawdź kursy przygotowawcze w Warszawie – www.marka.edu.pl